 |
|
 |
| Автор |
Сообщение
|
Евгений Колчин

Зарегистрирован: Чт 3 Октябрь 2002, 06:26
Сообщения: 10078
Регион: Москва

|
 Добавлено:
Вс 30 Октябрь 2016, 17:24 Добавлено:
Вс 30 Октябрь 2016, 17:24
|
  |
| Цитата: |
Находятся еще самородки которые ищут чудо. На сей раз удар пришелся по теплотехнике. С виду обычный газген, но в названии кроется нечто мифическое и непонятное. Наш народ любит такие вещи и несет свои кровные шарлатанам которые обещают КПД 115, 200 и даже 1600%.
Чем же они это аргументируют? Просто словами.
Что же такого привликательного в пиролизе?
Разберемся. Вместо обычной реакции
C + O2 =CO2 в результате которой получается 94 ккал/моль тепла, предлагают идти другим путем:
С + Н2О= СО + Н2 затратив 31,4 ккал/моль теплоты.
Зато потом получают
СО+0.5О2 =СО2 + 67.6 ккал/моль и
Н2 + 0.5О2 = Н2О + 57.8 ккал/моль в добавок.
Имеем приход 67,6 + 57,8 =125,4
Расход 31,4
И что же итого?
Итого 125,4 - 31,4 =94.
Тот же крен, только с боку. Но не знают шарлатаны, что водяной пар, вылетевший в трубу уносит с собой как минимум 12 ккал/моль драгоценного тепла в пустую потраченного на фазовый переход воды.
1:0 не в пользу шарлатанов.
Вы скажете, что при образовании СО выделяется 26,4 ккал/моль тепла. Есть такое дело, но в реакции
С + 0.5О2 = СО + упомянутые 26,4 ккал/моль.
Далее уже известно
СО + 0.5О2 =СО2 + 67,6 ккал/моль.
26,4 + 67,6 = 94
Опять тот же ..рен.
Есть еще более изощренные реакции
С + Н2О = СО + Н2 с потреблением 31,4 ккал/моль.
СО + Н2О =СО2 + Н2 + 10 ккал/моль в плюсе. Замечу, что один моль углерода мы уже про..рали.
Берем второй моль углерода, добавляем полученные в предыдущих реакциях 2 моля водорода
С + 2Н2 = СН4 + 76(не помню точно)ккал/моль тепла.
Потом всеми известная реакция
СН4 + 2О2 =СО2 + 2Н2О + порядка 130 ккал/моль тепла.
С двух молей углерода мы при нормальном сжигании получили бы 2*94 =188 ккал.
В этой реакции
Приход 130 + 76 +10
Убыль 31,4
Если сложить и отнять, то вырисовывается что-то похожее на 188. 2:0 Шарлатаны нервно курят! |
https://www.forumhouse.ru/threads/43862/
|
_________________
************************************
|
|
      |
 |
Шура

Зарегистрирован: Чт 8 Январь 2009, 20:09
Сообщения: 4142
Регион: Москва - Тамбов

|
 Добавлено:
Вс 30 Октябрь 2016, 20:01 Добавлено:
Вс 30 Октябрь 2016, 20:01
|
  |
| Евгений Колчин писал(а): |
| ...Шарлатаны нервно курят! |
А так же всякие водожоги, азотожоги и проч.
На мой взгляд, преимущества пиролизника, вполне реальные, заключаются в типе горения, а именно в том, что факел в топливнике пиролизника гомогенный, в отличие от гетерогенного факела в колосниковом топливнике. Проще говоря, пиролизник работает при альфе близкой к стехиометрическому значению, именно в этом его преимущество...
|
|
|
|
   |
 |
Кольчугин

Зарегистрирован: Вс 1 Апрель 2018, 03:26
Сообщения: 2135
Регион: Новосибирск

|
 Добавлено:
Ср 9 Май 2018, 08:14 Добавлено:
Ср 9 Май 2018, 08:14
|
  |
| Евгений Колчин писал(а): |
| Цитата: |
Находятся еще самородки которые ищут чудо. На сей раз удар пришелся по теплотехнике. С виду обычный газген, но в названии кроется нечто мифическое и непонятное. Наш народ любит такие вещи и несет свои кровные шарлатанам которые обещают КПД 115, 200 и даже 1600%.
Чем же они это аргументируют? Просто словами.
Что же такого привликательного в пиролизе?
Разберемся. Вместо обычной реакции
C + O2 =CO2 в результате которой получается 94 ккал/моль тепла, предлагают идти другим путем:
С + Н2О= СО + Н2 затратив 31,4 ккал/моль теплоты.
Зато потом получают
СО+0.5О2 =СО2 + 67.6 ккал/моль и
Н2 + 0.5О2 = Н2О + 57.8 ккал/моль в добавок.
Имеем приход 67,6 + 57,8 =125,4
Расход 31,4
И что же итого?
Итого 125,4 - 31,4 =94.
Тот же крен, только с боку. Но не знают шарлатаны, что водяной пар, вылетевший в трубу уносит с собой как минимум 12 ккал/моль драгоценного тепла в пустую потраченного на фазовый переход воды.
1:0 не в пользу шарлатанов.
Вы скажете, что при образовании СО выделяется 26,4 ккал/моль тепла. Есть такое дело, но в реакции
С + 0.5О2 = СО + упомянутые 26,4 ккал/моль.
Далее уже известно
СО + 0.5О2 =СО2 + 67,6 ккал/моль.
26,4 + 67,6 = 94
Опять тот же ..рен.
Есть еще более изощренные реакции
С + Н2О = СО + Н2 с потреблением 31,4 ккал/моль.
СО + Н2О =СО2 + Н2 + 10 ккал/моль в плюсе. Замечу, что один моль углерода мы уже про..рали.
Берем второй моль углерода, добавляем полученные в предыдущих реакциях 2 моля водорода
С + 2Н2 = СН4 + 76(не помню точно)ккал/моль тепла.
Потом всеми известная реакция
СН4 + 2О2 =СО2 + 2Н2О + порядка 130 ккал/моль тепла.
С двух молей углерода мы при нормальном сжигании получили бы 2*94 =188 ккал.
В этой реакции
Приход 130 + 76 +10
Убыль 31,4
Если сложить и отнять, то вырисовывается что-то похожее на 188. 2:0 Шарлатаны нервно курят! |
https://www.forumhouse.ru/threads/43862/ |
Если заняться цитированием, то неплохо и вот это почитать-https://www.libfox.ru/299749-o-derevenskiy-dogonyalki-s-teplotoy.html#book
|
|
|
|
   |
 |
Кольчугин

Зарегистрирован: Вс 1 Апрель 2018, 03:26
Сообщения: 2135
Регион: Новосибирск

|
 Добавлено:
Вс 5 Август 2018, 12:12 Добавлено:
Вс 5 Август 2018, 12:12
|
  |
| Евгений Колчин писал(а): |
| Цитата: |
Находятся еще самородки которые ищут чудо. На сей раз удар пришелся по теплотехнике. С виду обычный газген, но в названии кроется нечто мифическое и непонятное. Наш народ любит такие вещи и несет свои кровные шарлатанам которые обещают КПД 115, 200 и даже 1600%.
Чем же они это аргументируют? Просто словами.
Что же такого привликательного в пиролизе?
Разберемся. Вместо обычной реакции
C + O2 =CO2 в результате которой получается 94 ккал/моль тепла, предлагают идти другим путем:
С + Н2О= СО + Н2 затратив 31,4 ккал/моль теплоты.
Зато потом получают
СО+0.5О2 =СО2 + 67.6 ккал/моль и
Н2 + 0.5О2 = Н2О + 57.8 ккал/моль в добавок.
Имеем приход 67,6 + 57,8 =125,4
Расход 31,4
И что же итого?
Итого 125,4 - 31,4 =94.
Тот же крен, только с боку. Но не знают шарлатаны, что водяной пар, вылетевший в трубу уносит с собой как минимум 12 ккал/моль драгоценного тепла в пустую потраченного на фазовый переход воды.
1:0 не в пользу шарлатанов.
Вы скажете, что при образовании СО выделяется 26,4 ккал/моль тепла. Есть такое дело, но в реакции
С + 0.5О2 = СО + упомянутые 26,4 ккал/моль.
Далее уже известно
СО + 0.5О2 =СО2 + 67,6 ккал/моль.
26,4 + 67,6 = 94
Опять тот же ..рен.
Есть еще более изощренные реакции
С + Н2О = СО + Н2 с потреблением 31,4 ккал/моль.
СО + Н2О =СО2 + Н2 + 10 ккал/моль в плюсе. Замечу, что один моль углерода мы уже про..рали.
Берем второй моль углерода, добавляем полученные в предыдущих реакциях 2 моля водорода
С + 2Н2 = СН4 + 76(не помню точно)ккал/моль тепла.
Потом всеми известная реакция
СН4 + 2О2 =СО2 + 2Н2О + порядка 130 ккал/моль тепла.
С двух молей углерода мы при нормальном сжигании получили бы 2*94 =188 ккал.
В этой реакции
Приход 130 + 76 +10
Убыль 31,4
Если сложить и отнять, то вырисовывается что-то похожее на 188. 2:0 Шарлатаны нервно курят! |
https://www.forumhouse.ru/threads/43862/ |
Начнем с того что товарищ Глазков, который это все понаписал путает понятие пиролиз с понятием газогенерация...
Делает он шахтные котлы которые горят по принципу сходному с пиролизом, но только пиролиз у них (шахтеров) малоэффективный...
Что такое пиролиз и чем он так хорош, что Д. И. Менделеев еще в XIX веке писал:"что превращая дерево в древесный уголь или в воздушный (генераторный) газ, много процентов теряют из тепло-производительности исходного материала, но практически выгадывают в деле пользования топливом, потому что получают возможность при сжигании полученных продуктов достигать таких температур, каких само дерево, прямо сгорая, вовсе не может давать" (т.11 стр.373)
Если высушенную древесину поместить в закрытом стальном сосуде в печь с температурой 700—800°, то начнется бурное разложение древесины с выделением большого количества газа, отличающегося высокой теплотворной способностью (около 4000—4500 кал/м3). По калорийности такой газ удовлетворяет требованиям газа для бытовых целей. В XIX веке, когда не было электричества, такой газ из древесины и из каменного угля применяли для освещения. Отсюда до нашего времени сохранилось название газа — светильный. В настоящее время этот газ чаще называется искусственным бытовым в отличие от естественного природного газа. В СССР не существует высокотемпературного пиролиза, но организация его при использовании пирогенетическим путем древесных отходов была бы целесообразна при наличии потребности в бытовом газе в местностях, богатых древесиной, но далеких от мест добычи ископаемых видов топлива, природного и жидкого газа. Такой газ ценится так же как силовой газ для двигателей внутреннего сгорания. Пиролиз при высокой температуре легко сочетать с производством активного угля, который должен найти широкое применение в сельском хозяйстве.
Высокотемпературный пиролиз может дать смолы, которые отличаются большим выходом фенолов, содержащих значительное количество одноатомных фенолов, пригодных для изготовления связующих в производстве древесно-стружечных плит.
При пиролизе древесины при высоких температурах выход газа может достигать 30—35% от веса сухой древесины вместо 20—25% при обычной сухой перегонке При 400°. Соответственно выход древесного угля уменьшается до 20% вместо 25—30% по весу.
При высокой температуре уменьшается выход кислот и других ценных низкокипящих продуктов ввиду их термического распада при соприкосновении с раскаленными стенками и углем. Поэтому целесообразно для получения полного выхода кислот, спиртов и смол подвергнуть древесину пиролизу. в две стадии. Сначала при низких температурах (до 275°) провести так называемый предпиролиз, а затем пиролиз полученной бурой древесины при высоких температурах.
Для высокотемпературного пиролиза требуется хорошо высушенная древесина. Предпиролиз явится более целесообразным процессом, заменяющим сушку и позволяющим получить более высокие выходы ценных продуктов (кислоты, спирты, смолы).
Пиролиз при высокой температуре еще очень мало исследован, но по аналогии с коксохимическим производством высокотемпературная смола должна быть ценным сырьем для выделения не только фенолов, но и ряда других ценных химикатов.
Газ, получающийся при высокотемпературном пиролизе, после охлаждения и промывки в конденсаторной системе еще нельзя применять в качестве бытового газа. Для последнего существуют нормы более высокой степени очистки, так как в нем примеси смолы, воды, нафталина и других веществ должны быть ничтожны. Поэтому после грубой очистки газ необходимо подвергнуть тонкой очистке. Проведенные опыты показывают, что газ нужно пропускать через раскаленный до 800° уголь. При этом все примеси крекируются, т. е. подвергаются термическому распаду. Состав газа при этом также значительно изменяется, но в целом его теплотворность сохраняется, а общее теплосодержание даже несколько увеличивается.
Высокотемпературный пиролиз можно провести при температуре от 600 до 800°. Максимальный выход смолы получается при 600°, максимальный выход газа при 800°.На выход газа и его теплотворную способность влияет и способ нагрева древесины... При наружном нагреве теплосодержание пиролизных газов выше, чем при внутреннем нагреве из-за балластирующего действия азота...
Еще одна интересная особенность пиролиза это поглощение-выделение тепла... При нагреве от 200 до 350 гр.С процесс идет с поглощением тепла но после 350 гр.С процесс становится экзотермическим, т.е. идет с выделением тепла
В состав ПГ входят СО2, СО, СН4, С2Н2, Н2, а также пиролизная жижка (Кислоты, Метиловый спирт, Сложные эфиры, Альдегиды, Кетоны, Смолы), которая под действием высоких температур распадается на простые соединения или сгорает... Даже древесный уголь под действием высоких температур отдает газовую составляющую... Таким образом Пиролиз (Термолиз) позволяет получить из дерева горючие газы, которые сжигаются гораздо эффективнее(гомогенное горение), чем кусковое топливо (гетерогенное диффузионное горение)...
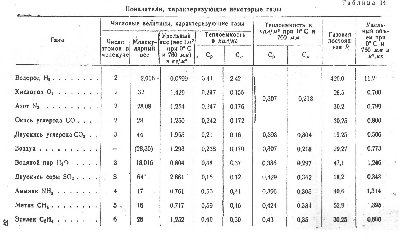
С повышением температуры термолиза (пиролиза) меняются и соотношения ПГ, причем газов с высокой жаропроизводительностью становиться больше, особенно водорода, зато уменьшается выход углекислого газа (см.табл)... Про газификацию расскажу в следующем сообщении...
|
|
|
|
   |
 |
Андрей_Алексеевич

Зарегистрирован: Пн 13 Декабрь 2010, 19:17
Сообщения: 5633
Регион: малая родина Павлова, Скобелева, Циолковского, Уткиных и др.

|
 Добавлено:
Вс 5 Август 2018, 14:12 Добавлено:
Вс 5 Август 2018, 14:12
|
  |
| Кольчугин писал(а): |
... целесообразно для получения полного выхода кислот, спиртов и смол подвергнуть древесину пиролизу. в две стадии.
Сначала при низких температурах (до 275°) провести так называемый предпиролиз, а затем пиролиз полученной бурой древесины при высоких температурах.
Для высокотемпературного пиролиза требуется хорошо высушенная древесина. Предпиролиз явится более целесообразным процессом, заменяющим сушку и позволяющим получить более высокие выходы ценных продуктов (кислоты, спирты, смолы)...
Газ, получающийся при высокотемпературном пиролизе, после охлаждения и промывки в конденсаторной системе еще нельзя применять в качестве бытового газа... после грубой очистки газ необходимо подвергнуть тонкой очистке. Проведенные опыты показывают, что газ нужно пропускать через раскаленный до 800° уголь...
Высокотемпературный пиролиз можно провести при температуре от 600 до 800°. Максимальный выход смолы получается при 600°, максимальный выход газа при 800°. На выход газа и его теплотворную способность влияет и способ нагрева древесины... При наружном нагреве теплосодержание пиролизных газов выше, чем при внутреннем нагреве из-за балластирующего действия азота...
Еще одна интересная особенность пиролиза это поглощение-выделение тепла... При нагреве от 200 до 350 гр.С процесс идет с поглощением тепла но после 350 гр.С процесс становится экзотермическим, т.е. идет с выделением тепла ... |
Не всё обрезал, оставил для общего впечатления... но Вы себе такую каменку, или Шведку - уже представили?
Вот как описано - с фильтрами, с камерами дожига и охлаждения..., с теплообменниками для выделения жидких фракций...
|
_________________
Печник - милостью и промыслом Божиим.
Печное отопление частного дома и т.п., авторское сопровождение проектов, наставничество в т.ч. дистанционное, партнёрство в кладке печей.
89106130763 МТС
andrejka61@mail.ru
andrej.kuzmischev@yandex.ru
|
|
   |
 |
Степанстепаныч
Зарегистрирован: Вт 18 Октябрь 2016, 09:03
Сообщения: 158
Регион: РФ

|
 Добавлено:
Вс 5 Август 2018, 15:16 Добавлено:
Вс 5 Август 2018, 15:16
|
  |
На картинке собирательный образ Андрея Алексеевича, Минчанина, Докторова и Мерзлякова
Колхоз не вытравить ничем. Плохо, когда колхоз начинает поучать или спорить. Колхоз не способен увидеть ничего кроме печки у бабки. Будто бы ничего другого нет в мире. Будто бы одна задача стоит, печурку в избушку бабке за магарыч возвести, а других задач не было и нет.
|
| Описание: |
|
| Размер файла: |
49.88 КБ |
| Просмотров: |
622 раз(а) |

|
|
|
  |
 |
Андрей_Алексеевич

Зарегистрирован: Пн 13 Декабрь 2010, 19:17
Сообщения: 5633
Регион: малая родина Павлова, Скобелева, Циолковского, Уткиных и др.

|
 Добавлено:
Вс 5 Август 2018, 18:01 Добавлено:
Вс 5 Август 2018, 18:01
|
  |
 ... чур, моя - кепочка! ... чур, моя - кепочка! 
Из струменту - полукувалдочка дедовская - "ласковая"...  почему он её так величал? она-ж так болюче по пальцам-то, да хоть и в башмаках... почему он её так величал? она-ж так болюче по пальцам-то, да хоть и в башмаках...
Да-а! ещё - отвёртка, на ней, взаправду, накладок нету... так досталась, да так и храню...
P.S. "... присвоить ... монтажник р/а 4-о разряда." (С)
|
_________________
Печник - милостью и промыслом Божиим.
Печное отопление частного дома и т.п., авторское сопровождение проектов, наставничество в т.ч. дистанционное, партнёрство в кладке печей.
89106130763 МТС
andrejka61@mail.ru
andrej.kuzmischev@yandex.ru
|
|
   |
 |
Кольчугин

Зарегистрирован: Вс 1 Апрель 2018, 03:26
Сообщения: 2135
Регион: Новосибирск

|
 Добавлено:
Вс 5 Август 2018, 18:18 Добавлено:
Вс 5 Август 2018, 18:18
|
  |
| Евгений Колчин писал(а): |
| Цитата: |
Находятся еще самородки которые ищут чудо. На сей раз удар пришелся по теплотехнике. С виду обычный газген, но в названии кроется нечто мифическое и непонятное. Наш народ любит такие вещи и несет свои кровные шарлатанам которые обещают КПД 115, 200 и даже 1600%.
Чем же они это аргументируют? Просто словами.
Что же такого привликательного в пиролизе?
Разберемся. Вместо обычной реакции
C + O2 =CO2 в результате которой получается 94 ккал/моль тепла, предлагают идти другим путем:
С + Н2О= СО + Н2 затратив 31,4 ккал/моль теплоты.
Зато потом получают
СО+0.5О2 =СО2 + 67.6 ккал/моль и
Н2 + 0.5О2 = Н2О + 57.8 ккал/моль в добавок.
Имеем приход 67,6 + 57,8 =125,4
Расход 31,4
И что же итого?
Итого 125,4 - 31,4 =94.
Тот же крен, только с боку. Но не знают шарлатаны, что водяной пар, вылетевший в трубу уносит с собой как минимум 12 ккал/моль драгоценного тепла в пустую потраченного на фазовый переход воды.
1:0 не в пользу шарлатанов.
Вы скажете, что при образовании СО выделяется 26,4 ккал/моль тепла. Есть такое дело, но в реакции
С + 0.5О2 = СО + упомянутые 26,4 ккал/моль.
Далее уже известно
СО + 0.5О2 =СО2 + 67,6 ккал/моль.
26,4 + 67,6 = 94
Опять тот же ..рен.
Есть еще более изощренные реакции
С + Н2О = СО + Н2 с потреблением 31,4 ккал/моль.
СО + Н2О =СО2 + Н2 + 10 ккал/моль в плюсе. Замечу, что один моль углерода мы уже про..рали.
Берем второй моль углерода, добавляем полученные в предыдущих реакциях 2 моля водорода
С + 2Н2 = СН4 + 76(не помню точно)ккал/моль тепла.
Потом всеми известная реакция
СН4 + 2О2 =СО2 + 2Н2О + порядка 130 ккал/моль тепла.
С двух молей углерода мы при нормальном сжигании получили бы 2*94 =188 ккал.
В этой реакции
Приход 130 + 76 +10
Убыль 31,4
Если сложить и отнять, то вырисовывается что-то похожее на 188. 2:0 Шарлатаны нервно курят! |
https://www.forumhouse.ru/threads/43862/ |
Теперь о газификации... Давайте в разрезе того что нам здесь с ФХ привели...
С+О2 = СО2+95,407ккал/моль (1)
Сразу необходима остановка и небольшое пояснение...
Реакция вроде простая и энергии много, но дело в том, что нет учета реакционной способности углерода... А она, эта реакционная способность такова, что с ростом температуры растет... То есть залетела молекула кислорода в слой углерода но при температуре в 1000 гр.С вылетит не одна молекула СО2 , а две молекулы СО, т.е. идет реакция:
С+СО2 = 2СО-39,893ккал/моль (2)
2СО+О2 = 2СО2 + 135,3ккал/моль (3)
получаем баланс: 135.3-39.893 = 95.407
Так вот реакция (2) является низкоэнергетической обратимой реакцией, т.е. идет как с образованием СО, так и с распадом СО... Кстати так, господа сажа образуется в печных каналах...
Равновесная температура 850гр.С... Равновесная,это значит что при 850 гр.С образуется 50% СО и 50% СО2... Как установлено наукой при 400гр.С 100% получается СО2, а при 1000гр.С 100% образуется СО... А теперь при скольки градусах начинается горение углерода? При 600гр.С... А какова температура в слое древесного угля при горении на колосниках? 1000-1200гр.С...
Первый вывод из писанины с ФХ - нет и никогда не было горения по (1) в чистом виде при горении происходит множество термохимических реакций и реальное горение никак не укладывается в простенькую форму (1), а идет по пути (1) и (3)
А товарищ с ФХ, которого цитирует Е. Колчин, сравнивает мягкое с круглым и открывает счет (как при нокдауне)... Таким образом вся та ерунда, что Glas (автор этой ерунды с ФХ)нам написал подобным образом не сравнивается...
Второй ляп в приведенной цитате, это реакция
С+2Н2 = СН4+18,152ккал/моль (4)
Реакция метанирования (4), также обратимая, как и все низкоэнергетические реакции и имеет равновесную температуру 540гр.С,
т.е.при температуре в 300гр.С содержание СН4 - 96,9%, Н2 -3,1%
при температуре в1000гр.С СН4 - 0,2%, Н2 - 99,8%
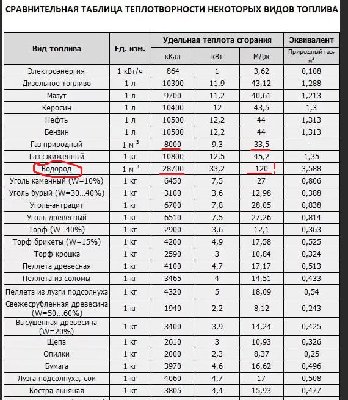
А теперь посмотрим на удельную теплотворную способность различных веществ Табл.
из которой следует что при сжигании 1м3 водорода получим 28700 ккал/м3, а при сжигании метана - 8558 ккал/м3...
На сегодня хватит, для осмысления...
Следующий раз расскажу про жаропроизводительность...
|
| Описание: |
|
| Размер файла: |
166.78 КБ |
| Просмотров: |
633 раз(а) |
|
Последний раз редактировалось: Кольчугин (Вс 5 Август 2018, 18:41), всего редактировалось 2 раз(а) |
|
   |
 |
Кольчугин

Зарегистрирован: Вс 1 Апрель 2018, 03:26
Сообщения: 2135
Регион: Новосибирск

|
 Добавлено:
Вс 5 Август 2018, 18:32 Добавлено:
Вс 5 Август 2018, 18:32
|
  |
| Андрей_Алексеевич писал(а): |
Не всё обрезал, оставил для общего впечатления... но Вы себе такую каменку, или Шведку - уже представили?
Вот как описано - с фильтрами, с камерами дожига и охлаждения..., с теплообменниками для выделения жидких фракций... |
А Вы что то кроме каменки, да шведки еще можете представить? То, где происходит горение с температурой 1500 гр.С и при этом в горелке нет золы... И горелка эта маленькая коробушка из 12 резанных кирпичиков, способна за пол часа столько воды нагреть, что Ваши шведки только за 7-8 часов смогут нагреть...
Так вот хочу Вам рассказать о том как и за счет чего подобное чудо возможно...
Вот увидел тот бред на который ссылается господин Е. Колчин, ну и знаете захотелось показать, что же есть на самом деле термохимия, газификация топлива, пиролиз и что они могут дать людям...
И объяснить что имел ввиду Менделеев, говоря о газификации древесины...
|
|
|
|
   |
 |
Кольчугин

Зарегистрирован: Вс 1 Апрель 2018, 03:26
Сообщения: 2135
Регион: Новосибирск

|
 Добавлено:
Вс 5 Август 2018, 19:02 Добавлено:
Вс 5 Август 2018, 19:02
|
  |
| Степанстепаныч писал(а): |
На картинке собирательный образ Андрея Алексеевича, Минчанина, Докторова и Мерзлякова
Колхоз не вытравить ничем. Плохо, когда колхоз начинает поучать или спорить. Колхоз не способен увидеть ничего кроме печки у бабки. Будто бы ничего другого нет в мире. Будто бы одна задача стоит, печурку в избушку бабке за магарыч возвести, а других задач не было и нет. |
Ломоносов тоже вроде колхоз, однако носы утер и русским и европейским...
Троих знаю, а Андрей Алексеевич это кто?
|
|
|
|
   |
 |
Степанстепаныч
Зарегистрирован: Вт 18 Октябрь 2016, 09:03
Сообщения: 158
Регион: РФ

|
 Добавлено:
Вс 5 Август 2018, 20:41 Добавлено:
Вс 5 Август 2018, 20:41
|
  |
Колхоз и деревня это не одно и тоже. Колхоз это колхоз. Он может быть и в Лондоне, отродясь.
|
|
|
|
  |
 |
Кольчугин

Зарегистрирован: Вс 1 Апрель 2018, 03:26
Сообщения: 2135
Регион: Новосибирск

|
 Добавлено:
Пн 6 Август 2018, 02:02 Добавлено:
Пн 6 Август 2018, 02:02
|
  |
Теперь немного о жаропроизводительности...
Еще в 19 веке Д. И. Менделеев ввел термин «жаропроизводнтельность», под которой понимается максимальная температура горения, развиваемая при полном сгорании топлива без избытка воздуха, т. е. в условиях, когда все выделяющееся при сгорании тепло полностью расходуется на нагрев образующихся продуктов сгорания..
Сегодня, такой процесс горения, еще называют- адиабатическим Адиабатическое горение — горение, происходящее при постоянном давлении или объёме, при котором отсутствуют потери энергии в окружающую среду. Адиабатическая температура горения — это температура продуктов, достигаемая при полном протекании химических реакций и установлении термодинамического равновесия.
Д. И. Менделеев в своих работах, посвященных научно обоснованному использованию топлива, большое значение придавал достижению высоких температур при его сжигании. Рассматривая различные свойства топлива, он указывал: «Когда горючие материалы служат для слабого нагревания, например для отопления жилищ, для сушки, для получения паров и т. п., тогда теплопроизводительность топлива прямо может служить мерилом его относительного достоинства.» .Он отмечал, что в большинстве случаев имеют значение и другие свойства горючих материалов, «из которых важнейшим должно считать способность давать высокие температуры. Это последнее свойство горючего материала необходимо не только потому, что требуется нередко самим существом дела, например для плавления стали требуется иметь температуру около 1450°, но и потому, что, чем выше температура, тем скорее при прочих равных условиях совершается доведение нагреваемых предметов до желаемой температуры и, следовательно, тем скорее идет производство, а потому продукты его удешевляются» [5, с. 224].
А в наших теплообменниках, для обогрева жилых помещений- нужно греть воду. Её все равно более 100гр. не нагреть, но она много крат быстрее нагреется- если подавать на конвективную поверхность наших котлов температуру дымогазов не 700-800гр,- а более 1500гр.
При обычном сжигании топлива- получают стандартные температуры пламени, не превышающие 700-900гр. В модернизированных топках, работающих на “кипящем слое” – температуры достигают 1000гр. Причем,- во всех случаях получают стандартную теплотворность, присущую тем видам топлива- которые и сжигают в тех топках.
Горючая масса дров и торфа с высоким содержанием кислорода обладает теплотой сгорания, значительно более низкой, чем горючая масса антрацита или каменного угля. Однако различие в жаро-производительности указанных видов топлива существенно меньше. Так, теплота сгорания горючей массы дров на 44% меньше, чем антрацита, а жаропроизводительность горючей массы ниже лишь на 9%.
Более сложная зависимость выявляется при сопоставлении теплоты сгорания и жаропроизводительности углерода и окиси углерода. Теплота сгорания 1 кг-атома углерода в виде графита равна около 94000 ккал, а 1 моля окиси углерода — лишь около 68000 ккал. Тем не менее жаропроизводительность окиси углерода равна 2370°С, т. е. почти на 200 град, выше жаропроизводительности графита (2175°С).
Указанное положение обусловлено тем, что присоединение к углероду первого атома кислорода связано с большой затратой энергии на разрыв связей между атомами углерода в графите. Вследствие этого из 94 000 ккал потенциального тепла 1 кг-атома углерода лишь около 26000 ккал, т. е. менее 30%, выделяется в результате присоединения первого атома кислорода и образования окиси углерода. Присоединение же второго атома кислорода с окислением СО до С02 сопровождается выделением 68 000 ккал тепла:
Перепишем уже известные нам реакции(1-3)из вида идеального горения в реальный вид:
С+0,5О2+1,88N2 = СО+1,88N2+26000кал/кг-атом (в)
СО+0,5О2+1,88N2 = СО2+1,88N2+68000кал/моль (б)
---------------------------------------------------------------
С+О2+3,76N2 = СО2+3,76N2+94000кал/кг-атом (а)
В результате при горении графита (а) на 1 моль продуктов сгорания выделяется около 20000 кал (94 000:4,76), а при горении СО (б) на 1 моль продуктов сгорания выделяется около 23 500 кал (68 000:2,88) (или 3016:1,25 = 2413кал х 28,01кг = 67582кал, по Равичу, где 3016 ккал/м3 – теплота сгорания; 1,25кг – вес1м3; 28,01кг молярный вес), т. е. значительно больше тепла. Этим и объясняется, что максимальная температура нагрева продуктов сгорания СО, т. е. жаропроизводительность окиси углерода, значительно выше жаропроизводительности графита…
Таким образом, горючая масса всех видов топлива — от антрацита и кокса до дров и торфа — с различным содержанием кислорода и различной теплотой сгорания характеризуется высокой жаропроизводительностью порядка 2000—2200 °С. (4. М. Б. Равич стр. 88)
А теперь сравним корректно (не как сравнивал г-н Глазков с ФХ) :
Сгорание 1 моля чистого углерода дает 20000кал
Сгорание 1 моля угарного газа дает 23500кал
-------------------------------------------------------
Выгода от сгорания СО перед С составит 3500кал
Это все в теории, а на практике?
А на практике если сравнивать горение газового топлива (СО в нашем случае) и кускового топлива, то картина для кускового топлива еще хуже, вследствие того, что горение газового топлива в среде газового окислителя очень хорошо перемешивается и горит быстро и жарко и называется гомогенным (однородном)...
А вот горение кускового топлива зависит от возможности доступа воздуха к топливу и зависит от диффузии (способности окислителя проникнуть к топливу и называется диффузионным или гетерогенным (разнородным)...
Гомогенное горение позволяет получить более высокие температуры и большее количество тепла, чем диффузионное горение...
А теперь еще раз прочитайте фразу Менделеева:
"превращая дерево в древесный уголь или в воздушный (генераторный) газ, много процентов теряют из тепло-производительности исходного материала, но практически выгадывают в деле пользования топливом, потому что получают возможность при сжигании полученных продуктов достигать таких температур, каких само дерево, прямо сгорая, вовсе не может давать." (Менделеев т.11 стр. 373)
(Продолжение следует)...
|
| Описание: |
|
| Размер файла: |
95.01 КБ |
| Просмотров: |
634 раз(а) |

|
|
|
   |
 |
Степанстепаныч
Зарегистрирован: Вт 18 Октябрь 2016, 09:03
Сообщения: 158
Регион: РФ

|
 Добавлено:
Пн 6 Август 2018, 09:40 Добавлено:
Пн 6 Август 2018, 09:40
|
  |
Уважаемый, Кольчугин, сколько читаю про синтез газ, про светильный газ, про производство водорода продуванием пара через угли и нигде не указано сколько 1кг углерода требуется для восстановления 1кг водорода. Ни теоретических данных, ни практических на этот счет не сыскать, хотя, это один из важнейших параметров в этом деле.
Может быть Вы владеете какой либо информацией? Есть у Вас такие данные? Только, пожалуйста, если можно, не в бимолях, лучше сразу, в кг.
|
|
|
|
  |
 |
Кольчугин

Зарегистрирован: Вс 1 Апрель 2018, 03:26
Сообщения: 2135
Регион: Новосибирск

|
 Добавлено:
Пн 6 Август 2018, 17:23 Добавлено:
Пн 6 Август 2018, 17:23
|
  |
| Степанстепаныч писал(а): |
Уважаемый, Кольчугин, сколько читаю про синтез газ, про светильный газ, про производство водорода продуванием пара через угли и нигде не указано сколько 1кг углерода требуется для восстановления 1кг водорода. Ни теоретических данных, ни практических на этот счет не сыскать, хотя, это один из важнейших параметров в этом деле.
Может быть Вы владеете какой либо информацией? Есть у Вас такие данные? Только, пожалуйста, если можно, не в бимолях, лучше сразу, в кг. |
Около 6 кг чистейшего углерода...
В бимолях и диезах ничего не приводил, с этим хозяйством лучше к Докторову...
|
| Описание: |
|
| Размер файла: |
237.13 КБ |
| Просмотров: |
626 раз(а) |
|
|
|
   |
 |
Степанстепаныч
Зарегистрирован: Вт 18 Октябрь 2016, 09:03
Сообщения: 158
Регион: РФ

|
 Добавлено:
Пн 6 Август 2018, 18:48 Добавлено:
Пн 6 Август 2018, 18:48
|
  |
Это практически, то, что получено на практике, по расходу и доходу. А теоретически?
|
|
|
|
  |
 |
Кольчугин

Зарегистрирован: Вс 1 Апрель 2018, 03:26
Сообщения: 2135
Регион: Новосибирск

|
 Добавлено:
Пн 6 Август 2018, 19:39 Добавлено:
Пн 6 Август 2018, 19:39
|
  |
| Степанстепаныч писал(а): |
| Это практически, то, что получено на практике, по расходу и доходу. А теоретически? |
А практики особо не замеряют, ибо нечем да и жарко...
Но посмотреть можете: https://www.youtube.com/watch?v=inm_hCAO5sE
С делами раскидаюсь, потом остановлюсь подробнее на синтез-газе...
|
|
|
|
   |
 |
Степанстепаныч
Зарегистрирован: Вт 18 Октябрь 2016, 09:03
Сообщения: 158
Регион: РФ

|
 Добавлено:
Вт 7 Август 2018, 09:43 Добавлено:
Вт 7 Август 2018, 09:43
|
  |
Я чего хотел спросить? Если у Н2О одна молекула кислорода, то сколько нужно молекул углерода для того, чтобы забрать у водорода кислород? На первый взгляд не сильно больше, чем один к одному.
Практически, это означает что выходит на практике, в промышленности, уж там то как раз все и замеряют, особо, до грамма. Получается столько то и столько то, как Вы писали тут, шесть к одному.
Существует ли теоретическое обоснование возможности или невозможности уменьшить это соотношение и приблизить его хотя бы к такому как один к двум?
Вы хотя бы приблизительно знаете ответ?
|
|
|
|
  |
 |
Кольчугин

Зарегистрирован: Вс 1 Апрель 2018, 03:26
Сообщения: 2135
Регион: Новосибирск

|
 Добавлено:
Вт 7 Август 2018, 13:02 Добавлено:
Вт 7 Август 2018, 13:02
|
  |
| Степанстепаныч писал(а): |
Я чего хотел спросить? Если у Н2О одна молекула кислорода, то сколько нужно молекул углерода для того, чтобы забрать у водорода кислород? На первый взгляд не сильно больше, чем один к одному.
Практически, это означает что выходит на практике, в промышленности, уж там то как раз все и замеряют, особо, до грамма. Получается столько то и столько то, как Вы писали тут, шесть к одному.
Существует ли теоретическое обоснование возможности или невозможности уменьшить это соотношение и приблизить его хотя бы к такому как один к двум?
Вы хотя бы приблизительно знаете ответ? |
Формула реакции С+Н2О = Н2+СО-20195кал/моль реакция эндотермическая(с поглощением тепла) реакция идет с температуры 700 гр.С и выше...
Молярный вес - Н2 - 2,016, С - 12, отсюда соотношение...
Сделать соотношение один к двум именно с этой реакции нельзя...
Диссоциация воды (разложение на Н2 и О) требует очень много энергии, и делает экономически нецелесообразным подобный путь использования водорода...
Диссоциация воды начинается с 1000 гр.С, но даже при 2000 гр.С процентное содержание составляет: 2%(водород, кислород), 98% (пары воды)
Степень диссоциации воды в зависимости от температуры:
при 1015 гр.С - 0,034%,
при 1711 гр.С - 0,74%,
при 2215 гр.С - 8,6%,
при 2483 гр.С - 11,1%
Отсюда первый вывод вода не горит, но не всякий пожар можно тушить водой...
|
|
|
|
   |
 |
Андрей_Алексеевич

Зарегистрирован: Пн 13 Декабрь 2010, 19:17
Сообщения: 5633
Регион: малая родина Павлова, Скобелева, Циолковского, Уткиных и др.

|
 Добавлено:
Вт 7 Август 2018, 15:24 Добавлено:
Вт 7 Август 2018, 15:24
|
  |
| Кольчугин писал(а): |
... Диссоциация воды (разложение на Н2 и О) требует очень много энергии, и делает экономически нецелесообразным подобный путь использования водорода...
Диссоциация воды начинается с 1000 гр.С, но даже при 2000 гр.С процентное содержание составляет: 2%(водород, кислород), 98% (пары воды)
Степень диссоциации воды в зависимости от температуры:
при 1015 гр.С - 0,034%,
при 1711 гр.С - 0,74%,
при 2215 гр.С - 8,6%,
при 2483 гр.С - 11,1%
Отсюда первый вывод вода не горит, но не всякий пожар можно тушить водой... |
Золотыми буквами!!!
Дед рассказывал, что вода, по-маленьку, капала из трубки в топке паровоза и, активно испаряясь, сильно перемешивала пиролизные ДГ, улучшая сгорание угля - огонь просто бушевал.
|
_________________
Печник - милостью и промыслом Божиим.
Печное отопление частного дома и т.п., авторское сопровождение проектов, наставничество в т.ч. дистанционное, партнёрство в кладке печей.
89106130763 МТС
andrejka61@mail.ru
andrej.kuzmischev@yandex.ru
|
|
   |
 |
Кольчугин

Зарегистрирован: Вс 1 Апрель 2018, 03:26
Сообщения: 2135
Регион: Новосибирск

|
 Добавлено:
Ср 8 Август 2018, 05:31 Добавлено:
Ср 8 Август 2018, 05:31
|
  |
| Андрей_Алексеевич писал(а): |
| Кольчугин писал(а): |
... Диссоциация воды (разложение на Н2 и О) требует очень много энергии, и делает экономически нецелесообразным подобный путь использования водорода...
Диссоциация воды начинается с 1000 гр.С, но даже при 2000 гр.С процентное содержание составляет: 2%(водород, кислород), 98% (пары воды)
Степень диссоциации воды в зависимости от температуры:
при 1015 гр.С - 0,034%,
при 1711 гр.С - 0,74%,
при 2215 гр.С - 8,6%,
при 2483 гр.С - 11,1%
Отсюда первый вывод вода не горит, но не всякий пожар можно тушить водой... |
Золотыми буквами!!!
Дед рассказывал, что вода, по-маленьку, капала из трубки в топке паровоза и, активно испаряясь, сильно перемешивала пиролизные ДГ, улучшая сгорание угля - огонь просто бушевал. |
Только путать не надо диссоциацию воды с термохимической реакцией С+Н2О+20195кал/моль = Н2+СО , условия для протекания которой создаются начиная с 700 гр.С и далее чем горячее, тем больше выход водорода...
Для поднятия теплосодержания топлива путем создания благоприятных условий(высокая температура) обычно достаточно связанной влаги топлива и влаги из воздуха... Если что то и подавать, то только дозированно, чтобы не переохладить зону реакции (реакция эндотермическая и сама забирает тепло из зоны реакции)... Потому не каждый конструктив годится для использования... На колоснике идет переохлаждение... И тот метод который описывал Кузнецов И. В. не более чем бред... Пример правильного использования: https://www.youtube.com/watch?v=inm_hCAO5sE&t=6s
Более удачной конструкции пока не встречал...
|
|
|
|
   |
 |
|
|
|
Следующая тема
Предыдущая тема
Вы не можете начинать темы
Вы не можете отвечать на сообщения
Вы не можете редактировать свои сообщения
Вы не можете удалять свои сообщения
Вы не можете голосовать в опросах
Вы не можете добавлять приложения в этом форуме
Вы можете скачивать файлы в этом форуме
|
|







 почему он её так величал? она-ж так болюче по пальцам-то, да хоть и в башмаках...
почему он её так величал? она-ж так болюче по пальцам-то, да хоть и в башмаках...


